Fig. 1. Inhaltsübersicht
Fig. 2. N. peronaeus: bei critical illness polyneuropathy CIP hochsensibel gegenüber der LPS-Konzentration im Blut des Pat ienten
Lipopolysaccharide (LPS) sind negativ geladene amphiphile Moleküle bestehend aus hydrophobem
Lipid A und hydrophilem Polysaccharid-Anteil. Negativ geladene Phosphat- und Carboxyl-Gruppen
des Lipid A bilden mit positiv geladenen Calcium-Ionen ein- bis mehrschichtige LPS-Vesikel.
Eine hohe Ca2+-Kozentration
liegt an spannungsgesteuerten Calcium-Kanälen von Nerven- und Muskelzellen vor. Ca2+
wird von LPS-Monomeren auch an den Calcium-Kanälen zu LPS-Aggregaten komplexiert, was
die Calcium-Kanäle teilweise oder sogar vollständig blockiert. Der Calcium-Kanal wird trotz erhöhten
Energieverbrauches mit gesteigerten ATP-Umsatz der Zelle nicht ausreichend Ca2+ in die
Zelle pumpen können, was sich elektrophysiologisch durch LPS-induzierte Leitungsblock in
Tierversuchen zeigt. In einem Fallbericht mit chronischer Endotoxämie nach einer Kontamination
mit 10 Mikrogramm Salmonella minnesota smooth-LPS zeigen sich diese Leitungsblocks elektrophysiologisch
speziell am Nervus peronaeus. Ferner ist bei der Patientin der zerebrale Glukose- und
Dopaminmetabolismus (Parkinsonismus) reduziert mit ödematischen Schwellungen und einer
Gliosenarbe im Kleinhirn.
Schlussfolgerungen: LPS-induzierte Leitungsblöcke erklären sich durch die Blockierung
der Calcium-Kanäle durch LPS-Aggregate. LPS wird intrazellulär aufgenommen und bindet auch
in Neuronen an Membranen des Golgi-Apparates und des endoplasmatischen Reticulums (ER).
Die intrazelluläre Ca2+-Bindung durch das LPS am ER behindert den Vesikeltransport
(auch der mit Neurotransmitter gefüllten Vesikel) mit Bildung von kristallisierenden
Protein-LPS-Aggregaten und Neurofibrillenbildung. An der Mitochondrienmembran kann durch
Komplexierung des Citrates mit Ca2+-Ionen der Citratzyklus blockiert sein mit nachfolgendem
Energiemangel für die Zelle. LPS stimuliert die Phospholipase C, was zu erhöhten intrazellulären
Ca2+-Spiegeln mit ödematischen Zellschwellungen führt. Mit Ca2+ komplexiertes
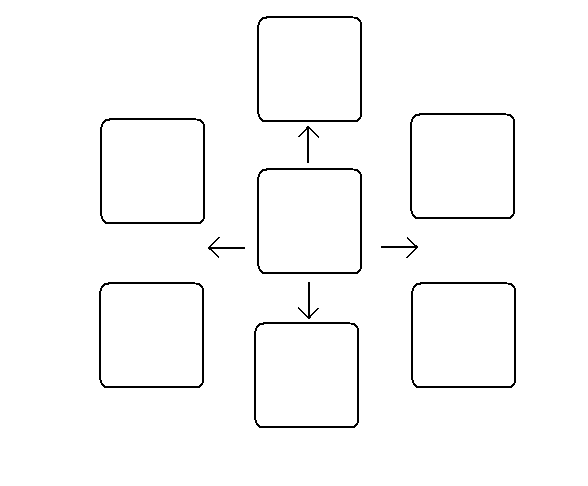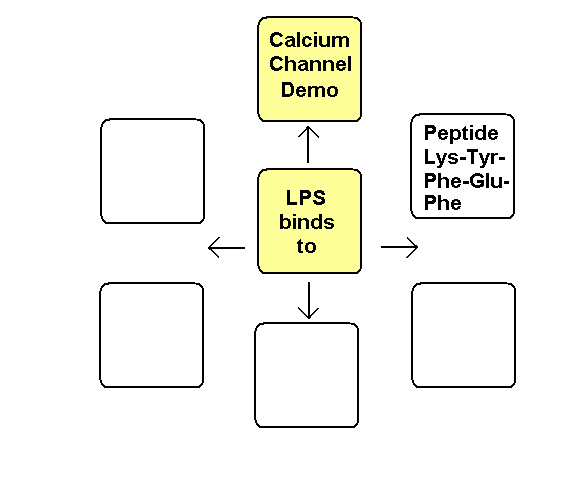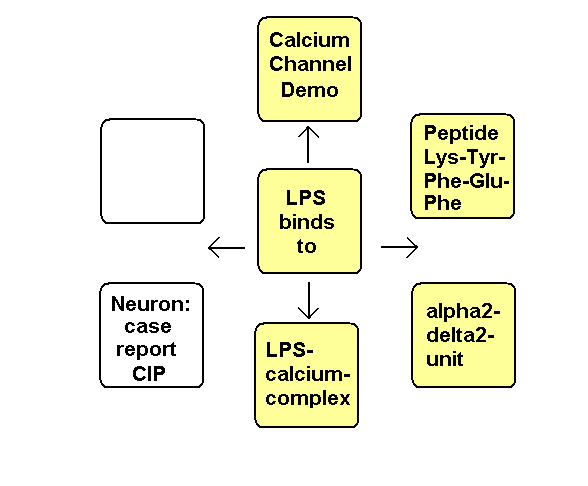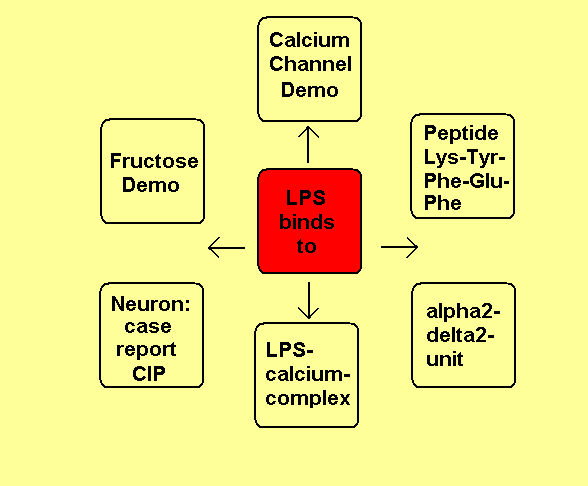
Fructose-1,6-biphosphat bindet vermutlich an LPS Aggregate, wodurch diese nicht mehr so
leicht an Ionenrezeptoren binden können. Dieses verhindert auch das Steroidhormon
Dehydroepiandrosteron DHEA mittels reversibler Bindung an Iono-Rezeptoren.
Der entzündungshemmende Dopamin-D2-Agonist Pramipexol verringert die LPS stimulierte
zyklische Adenosin-Monophosphat-Produktion.

Fig. 1.
Inhaltsübersicht
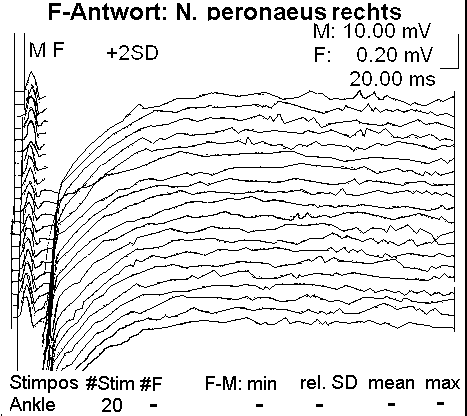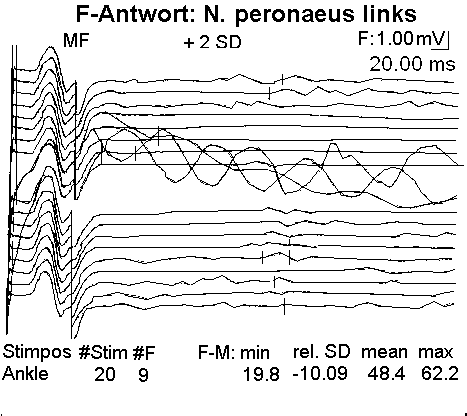
Fig. 2. N. peronaeus: bei
critical illness polyneuropathy CIP hochsensibel gegenüber der LPS-Konzentration im Blut des Pat
ienten
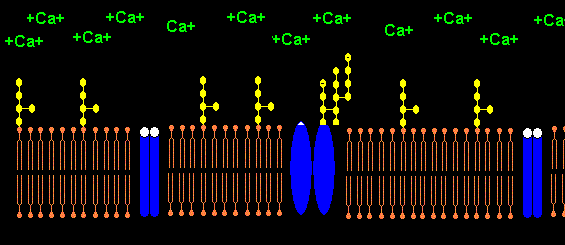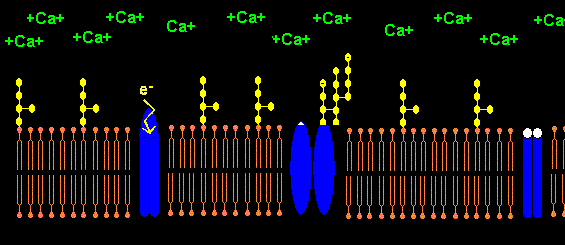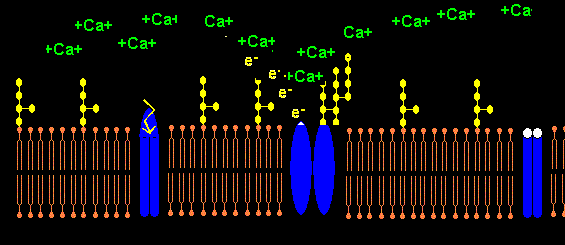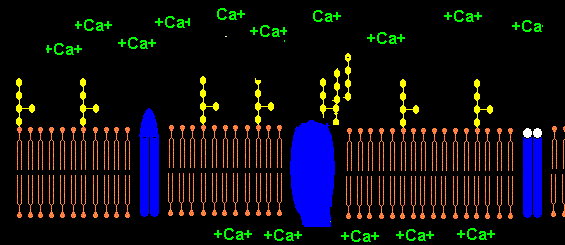
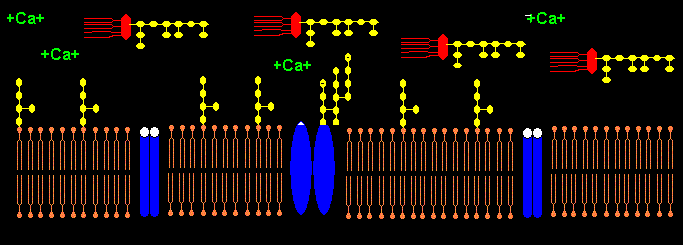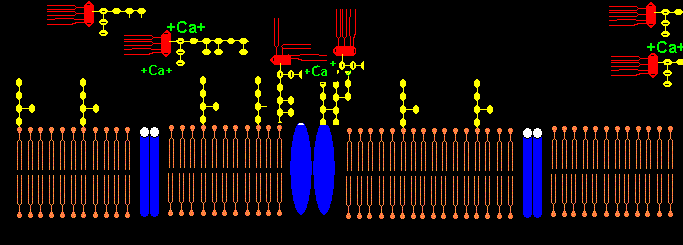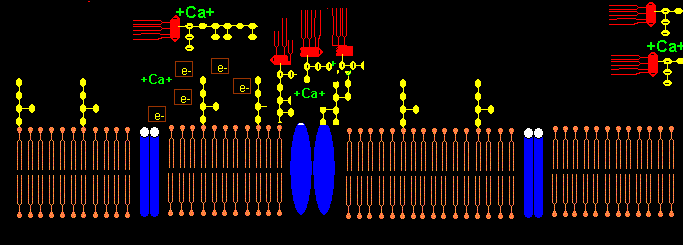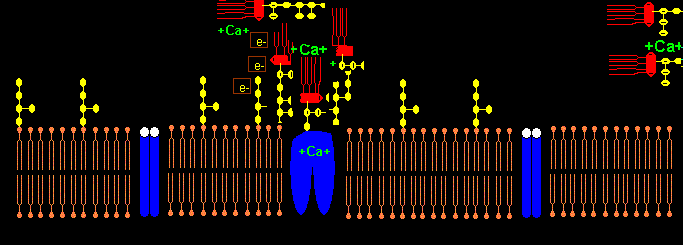
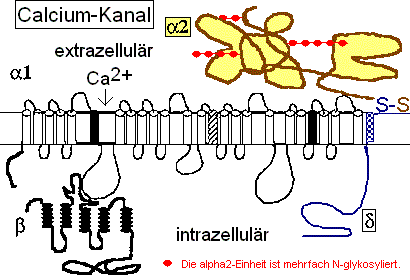
Das Pentapeptid Lysin+-Tyrosin-Phenylalanin-Glutamin-Phenylalanin der alpha2-delta2-Einheit bindet vermutlich ans Lipid A im LPS (Bindung von E.coli Lipid A an Lys-Phe-Ser-Phe-Lys)1. Lysin+ bindet dabei an KDO- bzw. Phosphat- des Lipid A. Das 2. Lysin+ des Pentapeptids ist bei Salmonella minnesota LPS zur Bindung des Lipid A nicht nötig, da das 2. Phosphat- mit einem positiv geladenem Aminozucker neutralisiert ist.
Die Aminosäuren 582-604 sind involviert in der Bindung von Gabapentin bzw. Pregabalin an Calcium-Kanäle.2 Ist Gabapentin in der Lage, LPS von der Bindung am Calciumkanal zu verdrängen und den auch beim Pat. beschriebenen Leitungsblock zu beheben?
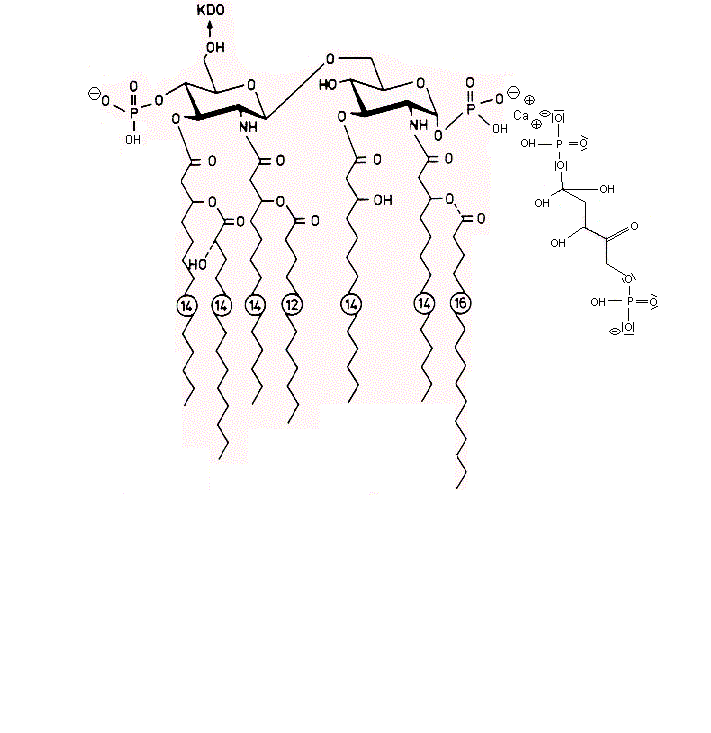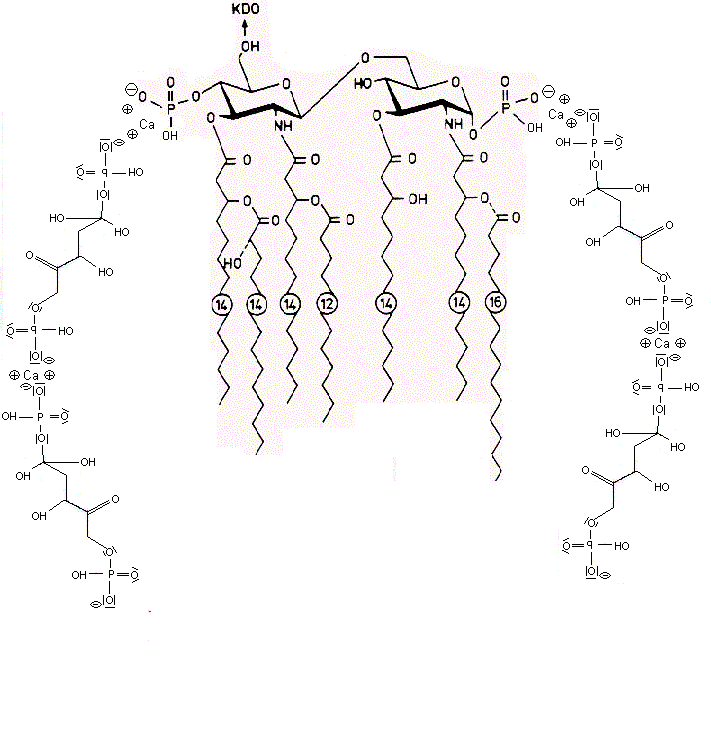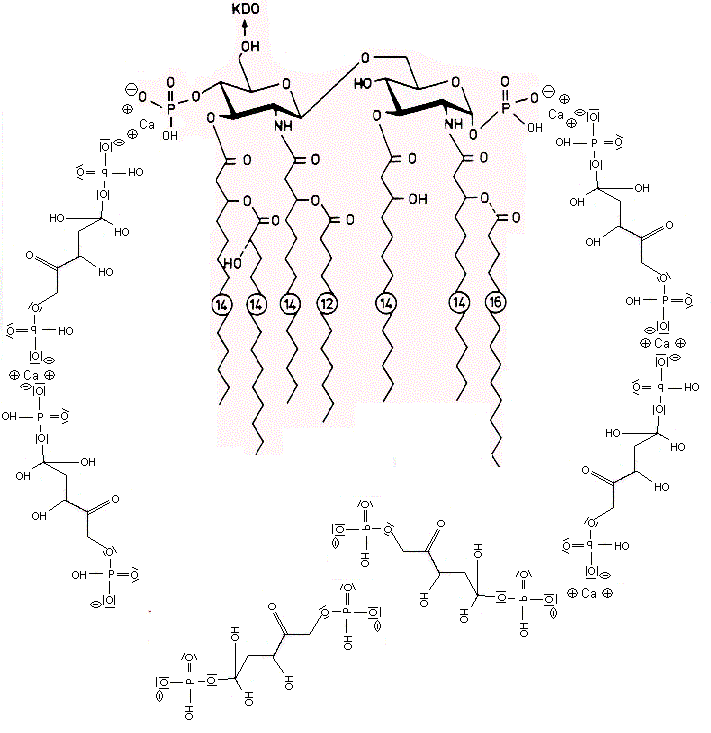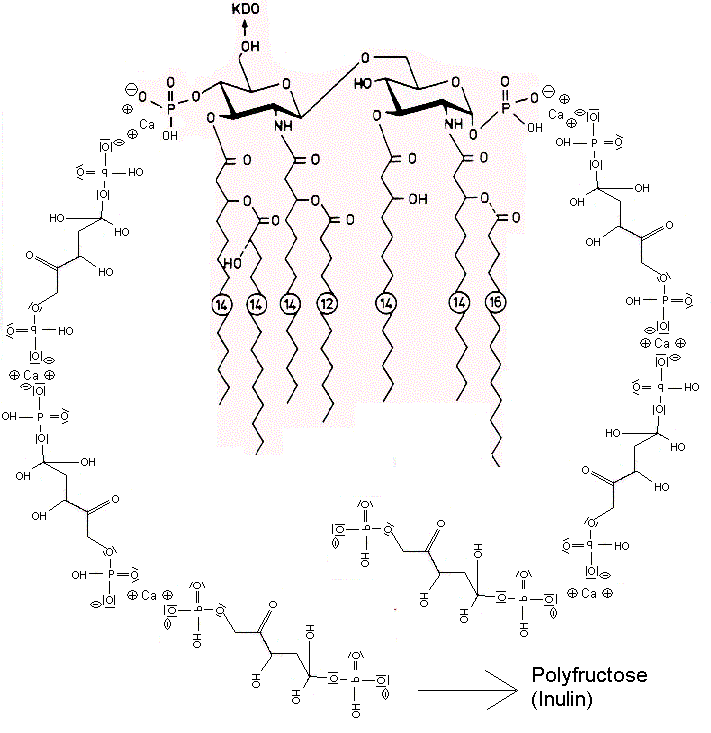
Die negativen Ladungen des KDO und Phosphats im Lipid A des LPS komplexieren mit Calcium-Ionen. Die Calcium-LPS-Komplexe binden an die alpha2-delta2-Einheit der spannungsgesteuerten Calcium-Kanäle und zwar mit den Polysaccharidketten an die N-glykolysierten Oligosaccharide des Kanals und mit dem Lipid A vermutlich an das Pentapeptid Lysin+-Tyrosin-Phenylalanin-Glutamin-Phenylalanin der alpha2-delta2-Einheit. Das Antiepileptikum Gabapentin bindet ebenfalls an diese Sequenz.
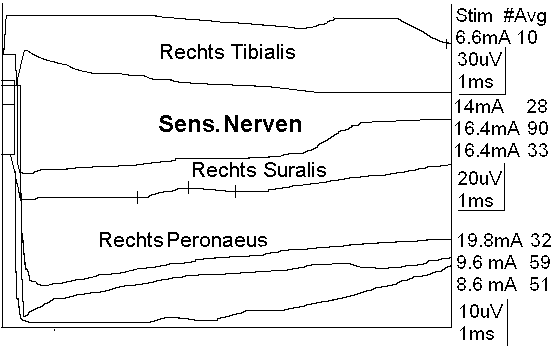
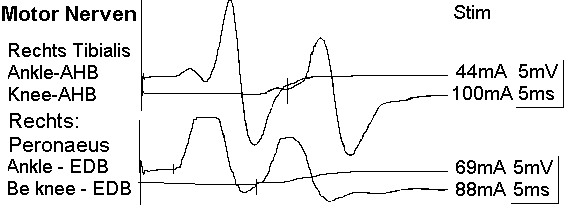
Der Leitungsblock3 erfolgt durch Blockade des Calcium-Einstroms in die mit Calcium-LPS-Komplexen besetzten Calcium-Kanäle. In dem Fallbericht liegt besonders eine Schädigung des N. peronaeus vor, der bei CIP hochsensibel gegenüber der LPS-Konzentration im Blut des Patienten ist.4
Dehydroepiandrosteron DHEA bindet an die Dihydropyridin-Bindungstelle im Calciumkanal als Calciumagonist. DHEA kann analog der Fructose die Raumstruktur des Lipid A so verändern, dass eine Bindung des LPS an Calcium-Kanäle erschwert wird. Die Polyfructose Inulin reduziert die Aufnahme von Endotoxin aus dem Darm in das Blut. Das Parkinsonmittel Pramipexol verringert als D2-Rezeptor-Agonist die LPS-stimulierte cAMP-Produktion, was sich entzündungshemmend auswirkt.
Die NADPH-Oxidase NOX5 trägt am C-terminalen Ende ab AS 737 ein LPS-bindendes Pentapeptid K-F-G-F-R im Gegensatz zu NOX1-NOX4. NOX5 hat 4 Calcium bindende sog. EF hand units. Wenn Calcium extrazellulär komplexiert wird mit EDTA, kann NOX5 kein H202 aus O2 produzieren und keinen intrazellulären Calciumeinstrom induzieren. NOX wird durch das Peptid GGF Gly-Gly-Phe (Bestandteil von Enkephalin) in femtomolarer Konz. gehemmt mit neuroprotektivem Effekt.5
Mehr Information über Leucin Enkephalin zur Behandlung von Sepsis induzierter Polyneuropathie
Referenzen:
1) Frecer V, Ho B, Ding JL.
Interpretation of biological activity data of bacterial endotoxins by simple
molecular models of mechanism of action.
Eur J Biochem. 2000; 267(3):837-52.
2) Marais E, Klugbauer N, Hofmann F.
Calcium channel alpha(2)delta subunits-structure and Gabapentin binding.
Mol Pharmacol. 2001; 59(5):1243-8.
3) Brown RF, Jackson GD, Martin T, Westbrook RF, Pollard JD, Westland KW.
Bacterial lipopolysaccharide induces a conduction block in the sciatic nerves of rats
Lab Anim Sci. 1999; 49(1):62-9.
4) Mohammadi B, Schedel I, Graf K, Teiwes A, Hecker H, Haameijer B, Scheinichen D,Piepenbrock S,
Dengler R, Bufler J.
Role of endotoxin in the pathogenesis of critical illness polyneuropathy.
J Neurol. 2008; 255(2):265-72.
5) Qin L, Block ML, Liu Y, Bienstock RJ, Pei Z, Zhang W, Wu X, Wilson B, Burka T,Hong JS.
Microglial NADPH oxidase is a novel target for femtomolar neuroprotection against
oxidative stress.
FASEB J. 2005; 19: 550-557
Diese Webseite wurde veröffentlich am 01.12.2008.
Letzte Änderung am 01.02.2010.